ENLACE COVALENTE
Es la fuerza electromagnética que mantiene unidos a átomos que comparten electrones, los cuales tienen espines o giros opuestos. Los átomos enlazados se encuentran neutros y generalmente son no metálicos.

Propiedades de los Enlaces Covalentes:
- A temperatura ambiental pueden ser sólidos, líquidos o gaseosos.
- Algunos pueden ser sólidos cristalinos
- Generalmente tienen baja temperatura de fusión y ebullición.
- Generalmente son insolubles en agua, pero si son solubles en solventes apolares
- Son aislantes, es decir, son malos conductores eléctricos.
Para su mejor estudio, estos enlaces se clasifican en:
SEGUN EL NUMERO DE PARES ELECTRONICOS ENLAZANTES:
1. Enlace Simple: Cuando entre los átomos enlazados se comparten un par de electrones.
ejemplo: Sulfuro de Hidrógeno (H2S)

2. Enlace Múltiple: Cuando los átomos enlazados comparten mas de un par de electrones, estos pueden ser:
a) Enlace doble: Compartición de dos pares de electrones.
ejemplo: el oxigeno (O2)
b) Enlace triple: Compartición de tres pares de electrones.
ejemplo: Nitrógeno (N2)
Según la estabilidad quimica los enlaces pueden ser sigma (σ) o pi(π), en forma practica estos enlaces se reconocen así:
SEGUN EL NUMERO DE ELECTRONES APORTADOS PARA FORMAR EL PAR ELECTRONICO ENLAZANTE:
1. Enlace Covalente Normal: Cada atomo aporta un electrón a la formación del enlace.
ejemplo: Cloro (Cl2)
ejemplo: Cloruro de Berilio (BeCl2)
2. Enlace Covalente Coordinado o Dativo: Solo uno de los átomos aporta el par electrónico enlazante.
ejemplo: Trióxido de Azufre (SO3)
SEGUN SU POLARIDAD:
1. Enlace Covalente Apolar o Puro: Es cuando los átomos comparten equitativamente a los electrones. Generalmente participan átomo del mismo elemento no metálico.
Se cumple que la diferencia de electronegatividades es cero: ∆EN = 0
ejemplo: Hidrogeno (H2)
2. Enlace Covalente Polar: Es cuando los electrones enlazantes no son compartidos en forma equitativa por los átomos, esto debido a que uno de los átomos es mas negativo que otro.
Se cumple que la diferencia de electronegatividades es diferente de cero: ∆EN ≠ 0
ejemplo: Yoduro de Hidrógeno
donde:
+/- δ : carga parcial
μ: momento dipolar del enlace, es aquel parámetro que mide el grado de polaridad de un enlace.


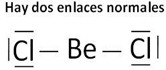


No hay comentarios:
Publicar un comentario